레바캄 정
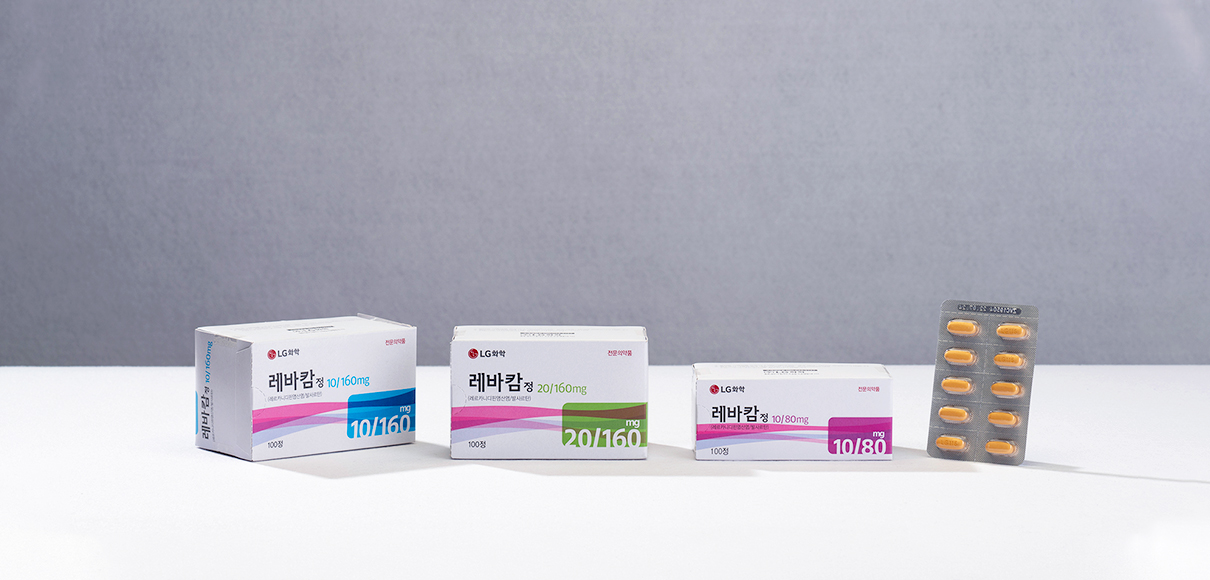

제품그룹
제품 구조 및 용도
주의사항
본 사이트에서 제공하는 제품정보는 국내용 제품을 기준으로 작성되었습니다. 국가별 정책 및 상황에 따라 제품 및 제품정보가 달라질 수 있습니다.


주의사항
본 사이트에서 제공하는 제품정보는 국내용 제품을 기준으로 작성되었습니다. 국가별 정책 및 상황에 따라 제품 및 제품정보가 달라질 수 있습니다.
1. 식품의약품안전처(의약품안전평가과)에서는 유럽 의약품청(EMA)의 "안지오텐신Ⅱ 수용체 길항제 계열" 성분 제제에 대한 안전성 정보와 관련하여, 국내·외 현황 등을 토대로 마련한 허가사항 변경명령(안)에 대하여 의견조회 및 사전예고를 실시한 바 있습니다.
2. 이에 「약사법」제31조제15항, 제76조제1항, 「의약품 등의 안전에 관한 규칙」제8조제3항제5호, 제12조, 「의약품의 품목허가·신고·심사 규정」제53조에 따라 "안지오텐신Ⅱ 수용체 길항제 계열" 성분 제제에 대한 사용상의 주의사항을 붙임과 같이 변경명령하였음을 알려드리니 관련 업무에 참고하시기 바랍니다.
○ 허가사항 변경 반영일자: 2026.2.12.
○ 해당 품목
-로바티탄정20/80밀리그램
-로바티탄정10/80밀리그램
-로바티탄정10/160밀리그램
-로바티탄정20/160밀리그램
-로바티탄정5/80밀리그램
-로바티탄정5/160밀리그램
-레바캄정10/80밀리그램
-레바캄정20/160밀리그램
-레바캄정10/160밀리그램
○ 변경 항목 : 사용상의 주의사항
3. 아울러, 관련 단체(협회) 등에서는 동 내용을 주지하시는 한편, 소속 회원사 및 비회원사 등에 널리 전파하여 주시고, 의약품 사전·사후 관련 기관(부서) 등에서는 향후 의약품 품목허가(신고수리) 등 민원서류의 검토 및 표시기재 사항의 사후관리 등 약사감시 관련 업무에 동 변경명령 사항을 활용하여 주시기 바랍니다.
의약품안전평가과-7895호('25.11.12.)
(주)엘지화학의 '레바캄정10/80mg 등 3품목'에 대한 재심사 결과를 토대로 "레르카니디핀염산염·발사르탄" 제제(복합제, 경구제)에 대하여 붙임과 같이 허가사항 변경지시하였음을 알려드립니다.
허가변경지시일 : 2020.6.29.
허가변경일: 2020.7.29.
대상품목: 총 3품목
(레바캄정10/80밀리그램, 레바캄정10/160밀리그램, 레바캄정20/160밀리그램)
의약품안전평가과-3782 (2020.6.29.)
「약사법」(법률) 제31조제9항, 제42조, 제76조제1항, 「의약품 등의 안전에 관한 규칙」(총리령) 제8조제4항 및 「의약품의 품목 허가·신고·심사 규정」(식품의약품안전처 고시) 제3조의2제2항제8호에 따라 다음과 같이 변경지시 합니다.
- 다 음 -
○ 허가사항 변경지시일 : 2019.9.4.
○ 변경허가 적용일자: 2019.9.4.~ 2020.9.3
○ 변경허가 적용방법: 적용일자를 업체에서 자율 선택 후 허가증(신고필증)에 이면기재 후 식약처(지방청 포함)에 연차보고
해당 내용의 자사 해당 품목은 총 17품목입니다.
- 노바스크브이정10/160밀리그램
- 노바스크브이정5/160밀리그램
- 노바스크브이정5/80밀리그램
- 노바스크티정40/10밀리그램
- 노바스크티정40/5밀리그램
- 노바스크티정80/5밀리그램
- 레바캄정10/160밀리그램
- 레바캄정20/160밀리그램
- 레바캄정10/80밀리그램
- 로바티탄정10/160밀리그램
- 로바티탄정10/80밀리그램
- 로바티탄정20/160밀리그램
- 로바티탄정20/80밀리그램
- 로바티탄정5/160밀리그램
- 로바티탄정5/80밀리그램
- 유리토스구강붕해정
- 유리토스정
| 제품군 | 제품명 | 보험코드 | 용도 |
|---|---|---|---|
|
전문의약
|
레바캄 정
|
10/80 mg : 668902550 10/160 mg : 668902560 20/160 mg : 668902570 |
고혈압치료제
|
